Das Patientenunterstützungsprogramm von
Fresenius Kabi
KabiCare® ist speziell für Patienten entwickelt, die mit einer chronisch-entzündlichen Erkrankung leben.
Klicken Sie hier, um sich für den Zugang zur gesamten Webseite zu registrieren.
Biologische Arzneimittel haben die Behandlung vieler chronischer Krankheiten und lebensbedrohlicher Erkrankungen revolutioniert. Als Biologika werden definitionsgemäß große komplexe Proteine bezeichnet, die aus lebenden Zellen entwickelt oder gewonnen werden und für die aufgrund ihrer einzigartigen Natur modernste rekombinante Biotechnologie eingesetzt wird.
Die folgende Tabelle fasst die Unterschiede zwischen einem konventionellen Arzneimittel und einem biologischen Arzneimittel zusammen.
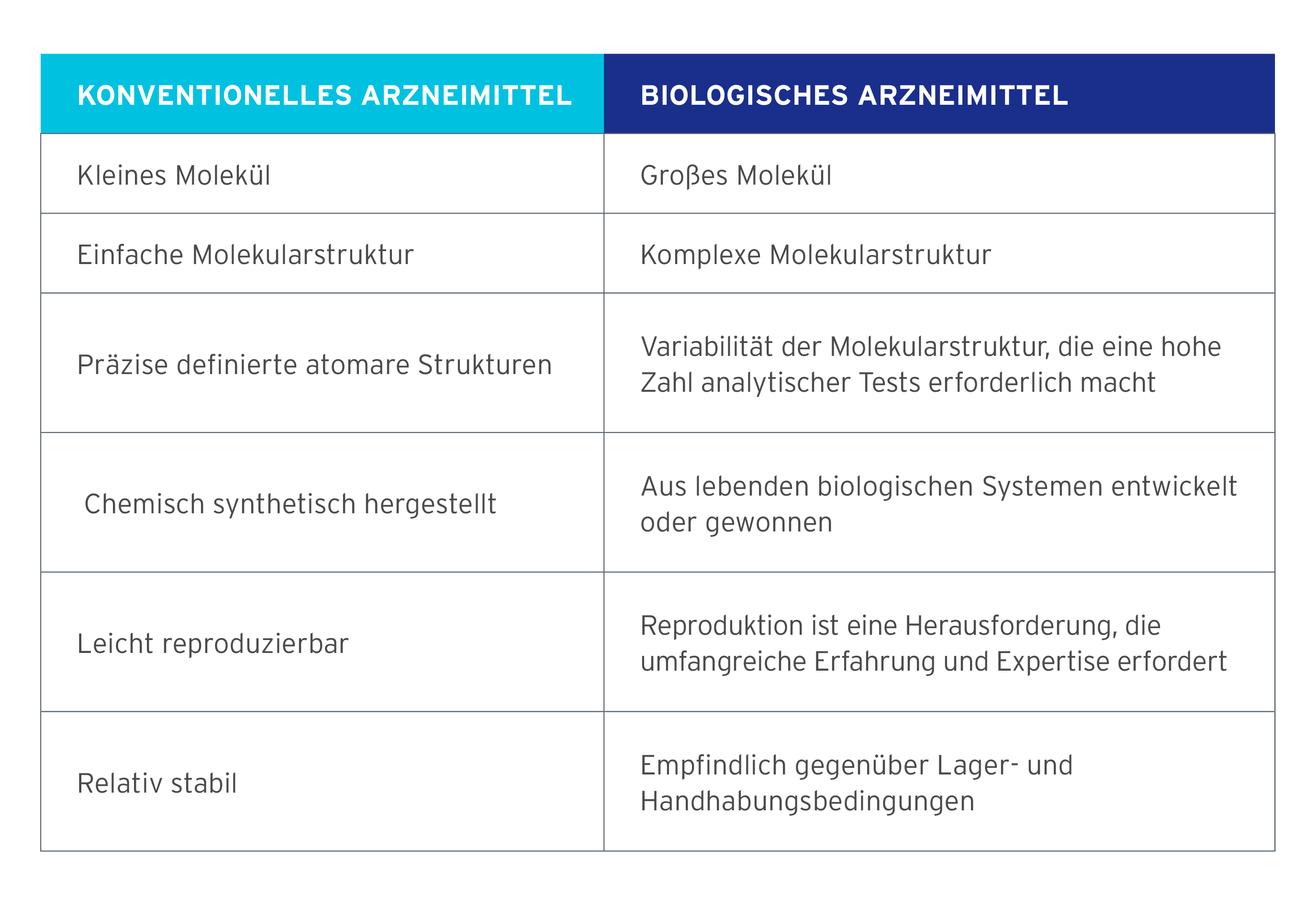
Der Begriff Biosimilar wird von der Europäischen Arzneimittelagentur definiert als „ein Arzneimittel, das einem anderen biologischen Arzneimittel sehr ähnlich ist und bereits im Europäischen Wirtschaftsraum vermarktet wird (dem sogenannten ‘Referenzprodukt‘)“. Biosimilars sind nicht dasselbe wie Generika. Ein Generikum ist mit einem Referenzprodukt in allen Aspekten, d. h. in Bezug auf Qualität und Leistungsmerkmal, identisch oder bioäquivalent, da es mittels chemischer Synthese hergestellt wird. Ein Biosimilar ist dem Referenzprodukt sehr ähnlich, jedoch nicht völlig mit diesem identisch, da es in lebenden Zellen hergestellt wird. Es gibt jedoch keine klinisch bedeutsamen Unterschiede in Bezug auf Wirksamkeit oder Verträglichkeit gegenüber dem Referenzprodukt.
Wenn ein Biologikum einige Jahre auf dem Markt ist und seinen Patentschutz verloren hat, können Pharmaunternehmen Biosimilars entwickeln und vermarkten. Im Gesundheitswesen besteht zunehmend Interesse daran, Biosimilars einzusetzen, da durch das Zulassungsverfahren sichergestellt ist, dass diese hinsichtlich Qualität, Wirksamkeit, Sicherheit und Immunogenität mit ihrem Referenzprodukt vergleichbar sind. Mit Biosimilars können im Gesundheitswesen Kosten eingespart werden, wodurch sich die Möglichkeit bieten kann, modernere Therapien einer größeren Zahl von Patienten zugänglich zu machen.
Biosimilars durchlaufen einen strengen Entwicklungsprozess. Zur Erlangung einer Zulassung muss in einem umfassenden Paket von analytischen Daten und klinischen Biosimilar-Studien die Vergleichbarkeit mit dem Referenzprodukt nachgewiesen werden.
Vergleichende Qualitätsstudien: In In-vitro-Untersuchungen werden die Proteinstruktur und die biologische Funktion von Biosimilar und Referenzprodukt mit modernsten analytischen Methoden verglichen.
Nicht-klinische Vergleichsstudien: Dazu gehören pharmakodynamische Untersuchungen (im Allgemeinen in vitro) zum Vergleich von Biosimilar und Referenzprodukt. In bestimmten Fällen sind zudem noch Toxikologiestudien erforderlich.
Klinische Vergleichsstudien: Klinische Studien sind maßgeschneidert, um die Biosimilarität (Ähnlichkeit) zu bestätigen und gegebenenfalls Fragen zu klären, die aus den analytischen und/oder funktionalen Studien offen geblieben sind. Auf Phase I Studien, zur Pharmakokinetik und Pharmakodynamik an gesunden Probanden, folgt die Bestätigung der Wirksamkeit und Sicherheit einschließlich der Immunogenität, in mindestens einer konfirmatorischen klinischen Phase III Studie, in einer möglichst sensitiven Indikation.
Eine Besonderheit beim Zulassungsprozess von Biosimilars ist die Möglichkeit der Extrapolation auf andere Indikationen des Referenzproduktes, wenn die Vergleichbarkeit eines Biosimilars mit dem Referenzprodukt in einer sensitiven Indikation des Referenzproduktes gezeigt werden konnte. Dies heißt, dass die Gesamtheit der Daten ("totality of evidence"), welche die hohe Ähnlichkeit des Biosimilars und des Referenzproduktes belegen, zusammen mit einer wissenschaftlichen Begründung genutzt werden können, um die Zulassung des Biosimilars für andere Indikationen des Referenzproduktes zu erhalten.
Die Verträglichkeit ist ein entscheidender Bestandteil für die Zulassung eines neuen Biosimilars, das keine klinisch bedeutsamen Unterschiede hinsichtlich der Immunogenität im Vergleich zum Referenzprodukt aufweisen darf. Immunreaktionen können sowohl die Verträglichkeit als auch die Wirksamkeit des Medikaments beeinflussen. In manchen Fällen kann eine spezielle Immunogenitätsstudie erforderlich sein.
Wie mit Erteilung der Zulassung bescheinigt, sind Biosimilars dem biologischen Referenzprodukt sehr ähnlich und weisen keine klinisch bedeutsamen Unterschiede zu diesem auf. Infolgedessen kann ein Patient, unter ärztlicher Anleitung und sorgfältiger Überwachung, von einem Referenzprodukt auf ein Biosimilar umgestellt werden. Es gibt immer mehr Daten auch aus dem therapeutischen Alltag die belegen, dass die Umstellung von einem Referenzprodukt auf ein Biosimilar keinen klinisch relevanten Einfluss auf die Wirksamkeit und Verträglichkeit hat.

Um auf den gesamten Inhalt der Website zuzugreifen, klicken Sie hier. Dieser Zugang steht ausschließlich Ärzten zur Verfügung.
Sie verlassen jetzt die KabiCare Website. Bitte beachten Sie, dass Sie auf eine andere Website weitergeleitet werden.
fortsetzen